Au premier semestre de cette année, la plateforme d'information standard du groupe national a annoncé les directives techniques pour les stratégies de contrôle de la contamination (CCS) pour la production de médicaments stériles (T/CPAPE 01-2024) organisées par la China Pharmaceutical Equipment Engineering Association. Le projet de ligne directrice a été publié le 7 septembre 2023 et a sollicité l’opinion du public. Elle est désormais officiellement mise en œuvre le 1er juin 2024. Bien que cette directive ne soit pas obligatoire, elle fournit des références techniques aux entreprises de production pharmaceutique et de recherche et développement, aux unités de conception d'installations d'usines, aux fabricants d'équipements, etc., et joue un rôle d'orientation important dans améliorer le contrôle de la pollution dans le processus de production pharmaceutique.
L'essor du concept de stratégie de contrôle de la contamination (CCS) n'est pas accidentel, mais un choix inévitable pour des générations de professionnels de la santé dans leur quête de qualité des médicaments......

01
D’où vient la stratégie de contrôle de la contamination (CCS) ?
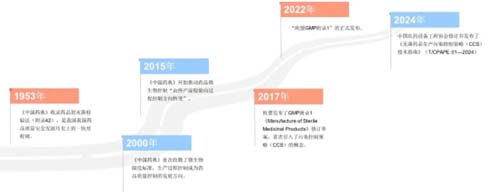
D’où vient la stratégie de contrôle de la contamination (CCS) ?
En décembre 2017, lorsque l'UE a publié le projet révisé de l'Annexe 1 des BPF « Fabrication de produits médicaux stériles » (« Annexe 1 des BPF de l'UE »), le concept de stratégie de contrôle de la contamination (CCS) est apparu pour la première fois et a été officiellement confirmé avec la sortie de « EU GMP Annexe 1 » le 22 août 2022. Parallèlement, la notion de libération des paramètres est également apparue dans le champ de vision du public. À mesure que les conditions de mise en œuvre continuent de mûrir, le contrôle des processus de production de médicaments stériles passera de la détection au contrôle des processus et à la libération des paramètres.
02
Qu’est-ce exactement qu’une stratégie de contrôle de la contamination (CCS) ?
L'annexe 1 des BPF de l'UE définit clairement la stratégie de contrôle de la contamination (CCS) [2] :

Les agences compétentes définissent le champ d'application de la stratégie de contrôle de la contamination (CCS) comme suit [3][4][5] :

03
Pourquoi devriez-vous vous soucier de la stratégie de contrôle de la contamination (CCS) ?
L'essence de la stratégie de contrôle de la contamination (CCS) est de contrôler les risques de contamination possibles dans tous les aspects du processus de production de médicaments et d'éliminer/réduire/prévenir les risques de contamination autant que possible grâce à des mesures scientifiques et systématiques, afin de garantir que les entreprises peut produire des produits de haute qualité, sûrs et fiables. Une fois la contamination survenue, le résultat est non seulement un gaspillage de matériaux, mais également une enquête détaillée et une rectification de la source de pollution, ce qui prend du temps et demande beaucoup de main-d'œuvre, et entraîne également une perte importante ; dans les cas graves, les autorités de régulation enquêteront et sanctionneront, voire retireront le produit du marché, ce qui est encore plus insupportable pour l'entreprise.
Les étapes typiques de l’élaboration et du maintien d’une stratégie de contrôle de la contamination sont les suivantes :

Exemple d'étapes pour développer et maintenir une stratégie de contrôle de la contamination
Sur cette base, il n’est pas difficile de voir que la stratégie de contrôle de la contamination (CCS) est une exigence inévitable pour s’adapter au développement de l’industrie en dehors de la Chine. Si les sociétés pharmaceutiques concernées souhaitent maintenir leur conformité et leur compétitivité, elles doivent comprendre que la formulation et le maintien de la stratégie de contrôle de la contamination (CCS) sont un processus dynamique et continu. S'ils veulent suivre le rythme des normes internationales, ils doivent intégrer la stratégie de contrôle de la contamination (CCS) dans le propre système qualité de l'entreprise, conserver les enregistrements correspondants, produire les documents pertinents, les résumer et les mettre à jour régulièrement.
04
Éléments de contrôle d’une stratégie de contrôle de la contamination (CCS)
Installations d'usine
Les installations des usines sont une garantie nécessaire pour la qualité de la production de médicaments. Les fabricants de produits pharmaceutiques doivent organiser leur personnel professionnel et technique pour planifier et concevoir des installations d'usine selon les exigences des différentes formes posologiques de médicaments, et effectuer une vérification pertinente pour confirmer que leurs performances peuvent répondre aux besoins attendus. Dans le cycle de vie des installations industrielles, une bonne conception ne suffit pas à elle seule. Son utilisation, son entretien, sa réparation et son suivi quotidien sont également des maillons indispensables. Dans le même temps, les installations des usines doivent être revues régulièrement pour garantir qu'elles peuvent continuer à contrôler efficacement la pollution. La formulation d'une stratégie de contrôle de la contamination est indissociable de la prise en compte globale de l'ensemble du cycle de vie des installations industrielles.
En prenant l’exemple des salles blanches, le choix des matériaux de décoration est directement lié à la propreté, à la sécurité, à la durabilité, aux coûts d’exploitation, etc. Compte tenu de l’utilisation généralisée des Désinfection au peroxyde d'hydrogène (VHP) dans les salles blanches, exigences plus élevées sont placés sur la résistance à la corrosion des cloisons de salle blanche .
En tant que fournisseur de solutions d'assemblage de décoration pour salles blanches/laboratoires, Pharma United a lancé Panel Asepticclean® Anti-VHP en réponse à cette demande. Après des tests internes rigoureux et une vérification sur le terrain par les clients de Pharma United, ce produit a démontré des avantages significatifs :
- L'épaisseur du revêtement de surface de Pharma-Unis Panel Asepticclean® Anti-VHP est aussi élevé que ≥150μm, ce qui est beaucoup plus élevé que celui d'une plaque d'acier colorée ordinaire revêtue d'un pré-rouleau (PPGI), montrant une excellente résistance au peroxyde d'hydrogène. De plus, comparé au revêtement en fluorocarbone (PVDF) et au revêtement en polyester (PE) pré-enduit au rouleau, Pharma United Aseptique® Anti-VHP Panneau fonctionne mieux en termes de performances.
- Comparé à l'acier inoxydable SS304, Panel Asepticclean® Anti-VHP non seulement évite la fatigue visuelle, mais ses propriétés faciles d'entretien réduisent également considérablement les coûts de maintenance. Son prix est également plus abordable, offrant aux utilisateurs un choix rentable.
équipement
La gestion des équipements comprend toutes les activités à toutes les étapes du cycle de vie des équipements. Un système de gestion des équipements efficace peut prévenir et contrôler au maximum la contamination potentielle dans le processus de production pharmaceutique. La conception, l'utilisation, l'entretien et la réparation des équipements, leur révision régulière, etc. sont autant de points clés de la stratégie de contrôle de la contamination. Un contrôle insuffisant d’un facteur ou un manque de lien entre les facteurs peut entraîner des défauts dans l’ensemble de la stratégie de contrôle de la contamination.
Dans le même temps, bien que la surveillance environnementale soit un moyen efficace de refléter le niveau de pollution environnementale, la variabilité de sa méthode de surveillance elle-même est relativement élevée. Les entreprises doivent comprendre que le niveau d'assurance de stérilité ne dépend pas de la surveillance environnementale et de la détection par simulation de processus aseptiques. Les données de surveillance environnementale visent davantage à identifier les changements dans le contrôle environnemental plutôt qu'à fournir des informations quantitatives sur les niveaux microbiens et les niveaux de particules dans l'environnement.
En général, depuis que l'Administration nationale des produits médicaux (NMPA) a progressivement rejoint l'ICH et est devenue un candidat officiel au PIC/S, les lois et réglementations pharmaceutiques chinoises se sont davantage alignées sur les normes internationales, ce qui a conduit à l'amélioration des normes d'inspection BPF de la Chine, le la coordination des normes d’inspection et le renforcement des forces de réglementation. Que les sociétés pharmaceutiques chinoises produisent et vendent localement ou exportent à l’étranger, la mise en place d’un système de stratégie de contrôle de la contamination (CCS) solide est une mesure nécessaire pour faire face à la supervision étrangère et améliorer la qualité des produits de l’entreprise.































